ニュース 医薬 作成日:2013年12月2日_記事番号:T00047338
衛生福利部食品薬物管理署(TFDA)は1日、台北市で11月27~29日に行った国際薬学連合(FIP)、米国薬学会(AAPS)との共同国際会議で、海外で開発された新薬の自国・地域での早期発売に向けて、今後臨床試験プロセスを相互に省略する方針で日米中など参加11カ国と合意したと明らかにした。TFDAは「新薬をめぐる海外との合意としては過去20年で最大の成果」と意義を評価した。2日付経済日報が報じた。
FIP年次総会に提出へ
同会議の招集人で、FIP法規副主席も務める胡幼圃考試委員は、ブリッジング試験(新薬の早期承認取得を目的に、海外の臨床試験データを活用して国内での重複試験を避けるための確認試験)について検討を重ねた結果、今後台湾を含む12カ国・地域で発売された新薬の輸入を希望する国・地域では、「薬物動態学」と「用量反応曲線」の2項目の試験のみを行い、異論がなければすぐに発売できるとする初期方針を固めたと説明した。結論は来年オーストラリアのメルボルンおよびタイで行われるFIPの年次総会に提出する。また、日米EU医薬品規制整合化国際会議の会員国にブリッジング試験に関連する規則の改正を依頼し、会員国および12カ国・地域で法令順守の体制を整える。3年以内に12カ国・地域それぞれが法律面で体制を整備することが目標だ。
胡考試委員は、実現すれば新薬1種類当たりで臨床試験費用6,000万~1億米ドルのコスト削減が可能なことに加え、販売利益も3~5年前倒しで獲得できるなどメリットが大きいと説明した。
今回の台北での国際会議に台湾の他、▽日本▽英国▽米国▽カナダ▽韓国▽シンガポール▽マレーシア▽タイ▽ニュージーランド▽インドネシア▽中国──の11カ国が参加した。
希少疾病のプラットフォーム創設
会議では希少疾病用医薬品(オーファンドラッグ)に関する検討会も行われ、同薬品に関する国際的な協力プラットフォームを創設することで意見がまとまった。多国・地域間での臨床試験の推進や、国際的な協力メカニズムの確立に努めるもので、最終的には同医薬品の法規制の標準化を図り、早期発売を目指す。
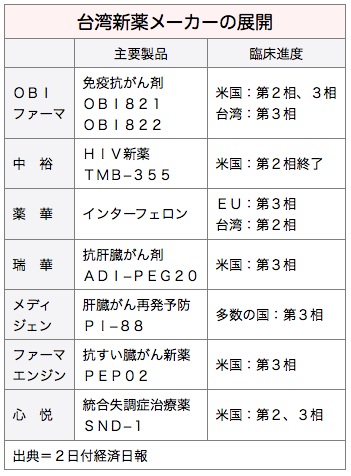
台湾はアジアの中でも希少疾病用医薬品に早くから注力しており、▽基亜生物科技(メディジェン・バイオテクノロジー)▽薬華医薬(ファーマ・エッセンティア)▽心悦生医(SyneuRx)▽台湾微脂体(タイワン・リポゾーム、TLC)▽智擎生技製薬(ファーマエンジン)▽懐特生技新薬(ファイトヘルス)▽台湾瑞華新薬研発▽景徳製薬(シンパック・キングダム)──の8社が開発に取り組んでおり、今回の合意で恩恵を受ける見通しだ。
【表】

台湾のコンサルティングファーム初のISO27001(情報セキュリティ管理の国際資格)を取得しております。情報を扱うサービスだからこそ、お客様の大切な情報を高い情報管理手法に則りお預かりいたします。

ワイズコンサルティンググループ
威志企管顧問股份有限公司
Y's consulting.co.,ltd
中華民国台北市中正区襄陽路9号8F
TEL:+886-2-2381-9711
FAX:+886-2-2381-9722