ニュース 医薬 作成日:2016年3月31日_記事番号:T00063313
東生華製薬(TSHバイオファーム)は30日、関節リウマチ治療薬のバイオ後続品(バイオシミラー)「ENIA11」の二重盲検法に基づく第3相臨床試験に成功したと発表。今後、衛生福利部食品薬物管理署(TFDA)に対し新薬認証を申請すると表明した。認証が取得できれば、台湾の製薬会社が自社開発した初のバイオシミラーとなる。31日付経済日報が報じた。
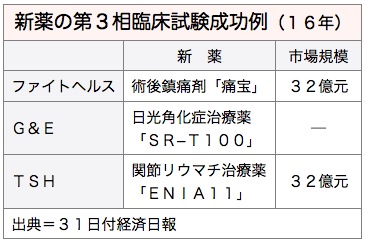
TSHによると、ENIA11については永昕生物医薬(マイセナックス・バイオテック)に授権して製品の初期開発、非臨床試験、第1~2相臨床試験を行った後、TSHが台湾北部の7病院および中南部の8病院で第3相臨床試験を進めていた。
これまで180人以上を対象に二重盲検法に基づく試験を実施したが、北部での試験の結果、ENIA11に統計学的に有意な効果が認められたという。
なおTFDAの新薬認証取得後はマイセナックスが生産を担い、TSHが中台での販売を手掛けることになる。
台湾リウマチ医学会によると、台湾には約4万人の関節リウマチ患者が存在し、治療薬の市場規模は32億台湾元(約110億円)とされる。

台湾のコンサルティングファーム初のISO27001(情報セキュリティ管理の国際資格)を取得しております。情報を扱うサービスだからこそ、お客様の大切な情報を高い情報管理手法に則りお預かりいたします。

ワイズコンサルティンググループ
威志企管顧問股份有限公司
Y's consulting.co.,ltd
中華民国台北市中正区襄陽路9号8F
TEL:+886-2-2381-9711
FAX:+886-2-2381-9722